24小时服务热线
13007546599
服务热线:13007546599
服务项目
Products Classification
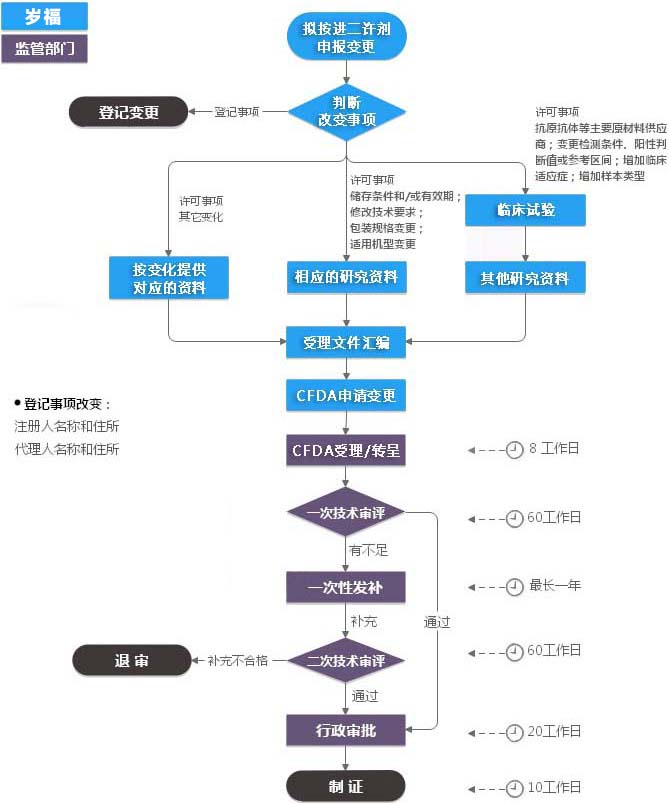
1、变更抗原、抗体等主要材料的供应商;
2、变更检测条件、阳性判断值或参考区间;
3、变更产品储存条件和/或有效期;
4、修改产品技术要求,但不降低产品有效性的变更;
5、进口体外诊断试剂生产地址的变更;
6、对产品说明书和/或产品技术要求中文字的修改,但不涉及技术内容的更改;
7、变更包装规格;
8、变更适用机型;
9、增加临床适应症;
10、增加临床测定用样本类型的变更;
11、其他可能影响产品有效性的变更。
1、注册人关于变更情况的声明
2、原医疗器械注册证及其附件复印件
3、历次医疗器械注册变更文件复印件
4、具体变更情况的其他技术资料要求
(1)变更抗原、抗体等主要材料的供应商相应资料;
(2)变更检测条件、阳性判断值或参考区间相应资料;
(3)变更产品储存条件和/或有效期相应资料;
(4)修改产品技术要求,但不降低产品有效性的变更相应资料;
(5)进口体外诊断试剂生产地址的变更相应资料;
(6)对产品说明书和/或产品技术要求中文字的修改,但不涉及技术内容的更改相应资料;
(7)变更包装规格相应资料;
(8)变更适用机型相应资料;
(9)增加临床适应症相应资料;
(10)增加临床测定用样本类型的变更相应资料;
(11)其他可能影响产品有效性的变更相应资料;
应当根据产品具体变更情况,提交该变更对产品性能可能产生的影响进行验证的试验资料(如涉及)。
5、境外申请人注册地或生产地址所在国家(地区)主管部门出具的批准变更的证明文件
6、境外申请人在中国境内指定代理人的委托书
7、代理人承诺书
8、代理人营业执照副本或者机构登记证明复印件
9、符合性声明和符合标准的清单
10、申请人所在地公证机构出具的关于英文/原文资料公证件
| 主管部门 | 产品 | 管理类别 | 首次注册 |
注册变更 (许可事项变更) |
延续注册 |
|---|---|---|---|---|---|
| 国家局(境外) | IVD | Ⅱ | 21.09 | 4.2 | 4.08 |
| 文件名称 | 文号 |
|---|---|
| 《医疗器械监督管理条例》 | 650号文件 |
| 《体外诊断试剂注册管理办法》 | 局令5号 |
| 关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告 | 2014年44号 |
立项阶段
预算、合同、考虑期,7个工作日。
受理前资料准备
资料提供、翻译及公证 1-2个月
*如需:产品检测,视产品情况有所变化。 *平均6个月
*如需:临床试验不可与检测并行,临床应单独核算时间。 *至少6个月
变更资料编制(可与检测或临床并行) 1个月
受理后
CFDA法定消耗预算5个月。(98工日,20工日/月,不计节假) 至少5个月
*发补(如适用):1、发补资料准备时限0~12个月视产品递交的申报资料情况而定。 *平均6个月
*发补(如适用):2、发补技术评审时间预计消耗3个月(60工作日) *3个月
*如需:体系考核,注册受理后,额外30工作日 *1.5个月
预算合计
无需重新检测、临床、体考、发补预算平均8个月
| 资料提供、翻译及公证 | 变更资料发补整改 |
| 延伸:IVD临床试验服务 |
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
河南岁福医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、GMP质量辅导等方面的技术外包和生产许可证、经营许可证及临床机构备案办理服务。